La farmacogenetica in oncologia
L’indice terapeutico della maggior parte degli agenti citotossici è ancora oggi un elemento critico di sicurezza del trattamento perché l’attività farmacologica contro le cellule tumorali è associata quasi invariabilmente a fenomeni di tossicità nei confronti dei tessuti sani. I recenti progressi delle metodologie analitiche e il sequenziamento del genoma hanno permesso la scoperta di varianti alleliche di geni coinvolti nel metabolismo dei farmaci, nella farmacocinetica o nella farmacodinamica; queste alterazioni possono essere correlate alla chemiosensibilità o alla tolleranza nei confronti dei farmaci.
La scoperta di correlazioni fra mutazioni geniche e differenti profili di espressione e suscettibilità dei tumori nei confronti dei farmaci dovrebbe rendere possibile una scelta più razionale del tipo di trattamento. Le analisi genetiche possono essere effettuate con un’ampia gamma di tecnologie adatte a individuare le alterazioni del materiale genico. Infine, il recente sviluppo della metodologia dei microarray del DNA permette lo screening dell’intero genoma con finalità diagnostiche.
L’identificazione di geni candidati per le analisi farmacogenetiche è un processo complesso perché l’attività dei chemioterapici antitumorali è influenzata da:
- attivazione e inattivazione metabolica
- espressione dei bersagli farmacologici
- integrità dei sistemi di trasduzione che riconoscono le lesioni cellulari e promuovono o inibiscono l’apoptosi
- efficacia dei sistemi di riparazione del DNA
- attività dei trasportatori attivi dei farmaci al di fuori delle cellule.
Il fine ultimo della farmacogenetica sarà la stratificazione dei pazienti in categorie in base alla loro probabilità di rispondere al trattamento con i farmaci e al rischio di tossicità in seguito al trattamento chemioterapico.
L’identificazione di fattori genetico-molecolari predittivi della tossicità ai farmaci antitumorali e il possibile sviluppo di un test genetico per la personalizzazione della terapia nei pazienti sono uno degli aspetti più innovativi della ricerca clinica in campo oncologico.
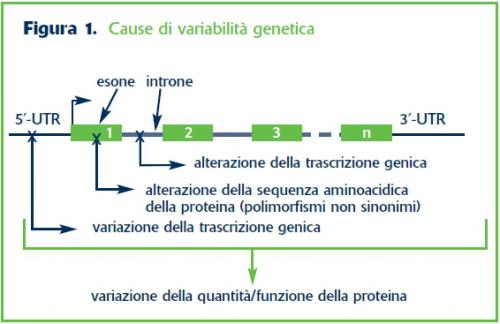
Le cause più frequenti di variabilità genetica consistono nella presenza di polimorfismi nelle regioni 5’-UTR e negli esoni; queste alterazioni possono, con maggiore probabilità rispetto ai polimorfismi intronici e della regione 3’-UTR, causare un’alterazione funzionale di proteine coinvolte nel metabolismo e/o nel meccanismo d’azione dei farmaci, modificando sensibilmente la tossicità o la risposta al trattamento farmacologico; a questo scopo, la farmacogenetica è la disciplina che studia le basi genetiche della risposta ai farmaci (Fig. 1, sopra).
Il caso delle fluoropirimidine
Le fluoropirimidine (5-fluorouracile e il suo profarmaco capecitabina) sono molto utilizzate, da sole o in associazione con altri chemioterapici, in oncologia nel trattamento di molti tumori solidi, come il tumore del colon-retto, della mammella e dell’area testa-collo come terapia adiuvante o della malattia metastatica. L’utilizzo di questi farmaci, tuttavia, può essere associato a grave tossicità di grado 3-4 gastrointestinale ed ematologica (31-34% dei casi), talvolta letale (0,5% dei casi). All’interno dell’organismo circa l’80% del 5-fluorouracile viene inattivato a 5-fluoro-diidrouracile (5-FDHU) a opera della diidropirimidina deidrogenasi (DPD), principale enzima del metabolismo delle fluoropirimidine. Una carenza nell’attività enzimatica della DPD indotta dalla presenza di polimorfismi nella regione codificante del gene può risultare nello sviluppo di gravi tossicità di grado 3-4 in seguito al trattamento con dosi standard del farmaco, come nausea e vomito, diarrea, stomatiti, leucopenia, neutropenia, neutropenia febbrile, piastrinopenia, anemia e sindrome mano-piede in circa il 30% dei pazienti.
Il gene della DPD è composto da 23 esoni e in letteratura sono riportati più di 30 polimorfismi tra esonici e intronici della DPD. La mutazione maggiormente caratterizzata è l’IVS14+1G>A che vede la sostituzione della prima base, una guanina (G), alla fine dell’esone 14, con una adenina (A) (Fig. 2). La mutazione non permette il riconoscimento del sito di splicing nella sequenza GT all’estremità 5’ dell’introne 14, causando la delezione dell’intero esone che precede la mutazione, con conseguente perdita di 165 bp, generando una proteina incompleta ad attività enzimatica assente. Per questo motivo i pazienti portatori della mutazione in eterozigosi IVS14+1GA necessitano di una riduzione del trattamento di almeno il 50% e i portatori del genotipo omozigote mutato IVS14+AA non devono essere trattati con fluoropirimidine perché tutti i soggetti portatori della mutazione in omozigosi andrebbero incontro a morte a causa di tossicità gastrointestinali ed ematologiche di massimo grado.
Oltre alla variante IVS14+1G>A sono state descritte in letteratura altre mutazioni del gene DPD, sebbene non tutte associate a un deficit enzimatico; pertanto la presenza di diversi polimorfismi nel gene che codifica per la DPD potrebbe spiegare la diversa suscettibilità nei pazienti oncologici allo sviluppo di tossicità dopo trattamento con fluoropirimidine. I dati della letteratura scientifica suggeriscono che la genotipizzazione possa essere un metodo più affidabile, rispetto all’analisi farmacocinetica e alla valutazione dell’attività enzimatica nei tessuti periferici, per identificare i pazienti oncologici a rischio di sviluppare gravi reazioni avverse. L’applicazione di un test di genotipizzazione della DPD nei pazienti ha indicazione primaria per l’esclusione dei soggetti portatori della mutazione IVS14+1G>A e viene regolarmente eseguito presso la nostra struttura mediante sequenziamento diretto del gene con risultato disponibile per il clinico oncologo entro 24 ore dalla consegna del campione. L’identificazione dell’importanza degli altri polimorfismi nella correlazione con lo sviluppo della tossicità necessita invece ulteriori studi.
- J Clin Oncol 2010;28:2556-64. CDI #nnr#
- J Intern Med Res 2010;38:1313-23. CDI #rrr#
- EPMA J 2010;1:495-502. CDI NS
- Clin Cancer Res 2003;9:4363-7. CDI NS
- Pharmacogenetics 2002;12:555-8. CDI NS
Marzia Del Re, Romano Danesi
UO Farmacologia, Dipartimento di Medicina Interna, Università di Pisa