La genetica affina la farmacovigilanza
E' noto che i pazienti possono rispondere in maniera diversa a un medesimo farmaco, generando uno spettro di risposte cliniche con effetti terapeutici e reazioni avverse diversi e variamente combinati nei diversi individui. In passato questa variabilità interindividuale veniva principalmente spiegata alla luce di fattori non genetici quali l’età, lo stato della funzionalità renale ed epatica, lo stile di vita, con particolare riferimento alla dieta e all’abuso di alcol e fumo, o la concomitante assunzione di altri farmaci. Sebbene tutti questi fattori possano certamente essere coinvolti e in alcune circostanze giustificare da soli la diversa risposta clinica al medesimo trattamento farmacologico, attualmente si ritiene che la risposta individuale ai farmaci abbia sempre una componente genetica, la quale rende conto, in alcune circostanze, fino al 95% della variabilità nelle risposte cliniche a un determinato farmaco. La variabilità individuale nella risposta al trattamento farmacologico costituisce uno degli aspetti più rilevanti nella pratica clinica essendo responsabile di fallimenti terapeutici e di reazioni avverse che a loro volta, oltre a danneggiare il paziente, possono causare ricoveri prolungati e aumento dei costi sanitari.
La farmacogenetica è la disciplina che studia come l’assetto genetico degli individui influenzi l’azione dei farmaci a essi somministrati, con l’obiettivo ultimo di predire e quindi prevenire reazioni avverse e/o fallimenti terapeutici, ma anche di favorire l’identificazione del farmaco giusto e del suo corretto dosaggio per ogni singolo paziente.
I diversi progetti di sequenziamento del genoma umano hanno dimostrato che la gran parte dei geni umani contiene differenze di sequenza tra individui, note come polimorfismi, con conseguenti forme alternative di un determinato gene, note come alleli. I polimorfismi possono essere di diverso tipo, ma i più numerosi sono i polimorfismi a singolo nucleotide, che nella letteratura scientifica internazionale vengono identificati con la sigla SNPs (Single Nucleotide Polymorphisms).
I polimorfismi a singolo nucleotide possono influenzare la quantità o la qualità del prodotto di un determinato gene, cioè della proteina da esso codificata. Per esempio, uno SNP nella regione codificante di un gene può causare la sostituzione di un aminoacido nella relativa proteina. Se la proteina fosse un enzima responsabile del metabolismo epatico di alcuni farmaci, potrebbe metabolizzarli meglio o peggio oppure, se fosse un recettore, potrebbe legare meglio o peggio un determinato farmaco.
I geni che determinano la risposta ai farmaci possono essere distinti in due grandi classi: i geni codificanti per il bersaglio terapeutico primario, come per esempio recettori, canali ionici o enzimi e i geni codificanti per proteine coinvolte nell’assorbimento, distribuzione,metabolismo ed escrezione del farmaco. I polimorfismi a carico dei diversi membri della famiglia del citocromo P450 (CYP450), responsabili del metabolismo di numerosi farmaci, sono quellimaggiormente studiati sia a livellomolecolare, valutandone gli effetti sulla funzionalità enzimatica, sia a livello clinico, valutandone l’impatto sulla risposta terapeutica. Per esempio è stata dimostrata l’esistenza di varianti alleliche del CYP2C9 (note come CYP2C9*2 e CYP2C9*3) che codificano per enzimi con una ridotta funzionalità. In soggetti portatori di queste varianti, e in particolare modo negli omozigoti, la somministrazione di dosi standard di warfarin è più spesso accompagnata da emorragie, soprattutto del tratto gastroenterico. La frequenza degli alleli CYP2C9*2 e CYP2C9*3 è rispettivamente dell’ 8-13% e del 6-9% tra i Caucasici, e questo ha indotto le autorità regolatorie europea e statunitense a chiedere la segnalazione in scheda tecnica del ruolo di queste varianti nella risposta terapeutica al warfarin e ad approvare l’uso del test genetico per identificare preventivamente i portatori di queste varianti alleliche.
In alcuni casi i farmaci sono introdotti nell’organismo come profarmaci, cioè comemolecole inattive che richiedono di essere metabolizzate in forma attiva proprio da alcuni enzimi della famiglia del citocromo P450. Nel caso dei profarmaci le conseguenze terapeutiche dei polimorfismi sono opposte a quelle osservate con i farmaci. Il clopidogrel per esempio è un profarmaco che dopo somministrazione orale viene rapidamente inattivato all’85% a livello epatico per l’azione di esterasi. Il restante 15% deve subire due fasi di reazioni di attivazione nelle quali giocano un ruolo fondamentale diversi citocromi P, con particolare riferimento al CYP2C19. Numerosi studi clinici hanno mostrato che i portatori di varianti non funzionanti di questo enzima possiedono una ridotta concentrazione plasmatica di metabolita attivo, hanno una maggiore reattività piastrinica e vanno incontro più spesso e inmaniera statisticamente significativa a eventi cardiovascolari, quali la morte, l’infarto e l’ictus.
I progressi della farmacogenetica stanno lentamente modificando i criteri di appropriatezza terapeutica, dimostrando, accanto alle altre variabili note, il ruolo fondamentale dell’assetto genotipico del paziente. I vantaggi delle applicazioni cliniche della farmacogenetica sono evidenti: unamigliore qualità dell’intervento terapeutico, con una scelta più razionale della dose, un uso più sicuro dei farmaci da parte del medico, che potrà richiedere la genotipizzazione del paziente in relazione a determinati trattamenti terapeutici così come oggi richiede i comuni esami del sangue, una ricerca più razionale e motivata per sviluppare strategie terapeutiche alternative al fine di curare i soggetti che non possono assumere uno specifico principio attivo, e infine un risparmio di denaro dovuto all’eliminazione di terapie inefficaci e di ricoveri causati dagli effetti avversi dei farmaci.
RISCHIO DI OSPEDALIZZAZIONE NEI SOGGETTI SOTTOPOSTI A SCREENING GENETICO PRIMA DI INIZIARE LA TERAPIA CON WARFARIN*
L’identificazione dei portatori di varianti alleliche del CYP2C9 e VKORC1 consente di modificare la terapia, adattandola, con il risultato di ridurre sia l'ospedalizzazione per tutte le cause, sia quella specifica per sanguinamento e tromboembolismo.
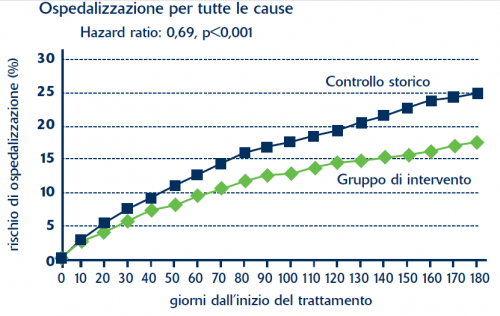
- Curr Pharm Des 2010;16:204-19. CDI NS
- N Engl J Med 2011;364:1144-53. CDI #fff#
- * modificato da N Engl J Med 2011;364:1144-53.
Diego Fornasari
Dipartimento di Farmacologia, Chemioterapia e Tossicologia Medica, Università degli Studi di Milano