focus /
La segnalazione spontanea in Italia nel 2009
I più attenti tra i nostri lettori sanno che questo numero del bollettino è tradizionalmente dedicato all’analisi della segnalazione spontanea in Italia. Rileggendo gli articoli degli anni passati è possibile capire l’evoluzione del sistema della segnalazione in Italia, dalle difficoltà da noi evdenziate già negli anni novanta fino alle novità degli ultimi anni.
La segnalazione spontanea ha avuto un’ulteriore forte crescita numerica nel corso del 2009 e i primi mesi del 2010 mostrano che la tendenza all’aumento continua. Nel sito del Gruppo interregionale di farmacovigilanza è pubblicata un’analisi dettagliata della situazione relativa al 2009 (www.gruppogif.org). In questo articolo ci limitiamo a richiamare i punti più importanti di questa analisi.
Nel 2009 le segnalazioni sono state 14.583 con un tasso di segnalazione di 242,9 segnalazioni per milione di abitanti e un incremento del 27% rispetto al 2008. L’incremento ha riguardato sia i farmaci (+16%) sia i vaccini (+77%); complessivamente le segnalazioni da vaccino rappresentano il 24% del totale delle segnalazioni, incluse ovviamente quelle relative al vaccino pandemico (che abbiamo commentato nello scorso numero di FOCUS). Pur tenendo conto degli effetti della pandemia H1N1 è indubbio che la segnalazione spontanea in Italia continui a crescere. Le ragioni di questo buon andamento sono molte e sono state già discusse negli anni scorsi: buon coordinamento e finanziamento delle attività di farmacovigilanza da parte dell’Agenzia italiana del farmaco, inserimento e operatività dei Centri regionali di farmacovigilanza, impegno nelle attività di formazione/incentivazione dei segnalatori e nella raccolta dei dati da parte dei responsabili di farmacovigilanza delle ASL.
La figura sopra mostra il tasso di segnalazione del 2009 nelle diverse regioni.
Con le sole eccezioni di Toscana (-3%), Puglia (-17%) e Abruzzo (-24%) le segnalazioni sono aumentate in tutte le regioni. L’aumento più vistoso è stato registrato in Molise (tasso di segnalazione da 41 a 387, 124 segnalazioni totali nel 2009). La Lombardia è la regione con il maggiore tasso di segnalazione (ben 581 segnalazioni per milione di abitanti con un incremento del 43% rispetto al 2008) e il maggior numero assoluto di segnalazioni (5.661, circa il 40% del totale). La variabilità è comunque alta e molte regioni densamente popolate quali la Sicilia, il Piemonte, la Campania, la Puglia e il Lazio hanno tuttora un tasso di segnalazione basso. Ciò rende possibile in prospettiva un’ulteriore crescita del sistema. Circa il 30% delle segnalazioni sono definite gravi, in gran parte perché è riferita l’ospedalizzazione o il prolungamento dell’ospedalizzazione, includendo 181 casi a esito fatale. I valori sono in linea con quanto segnalato negli anni precedenti e ribadiscono la rilevanza del problema delle reazioni avverse da farmaco, spesso sottovalutato dagli operatori sanitari. E’ noto infatti che solo il 5% delle reazioni avverse che avvengono nella pratica medica viene segnalato [1].
Ma i dati relativi alla gravità delle reazioni diventano ancora più rilevanti se li associamo al fatto che almeno il 50% delle reazioni avverse, secondo quanto riportato in letteratura, può essere giudicato prevenibile e quindi anche evitabile [2]. E’ evidente come investire in questo settore possa avere importanti ricadute non solo sulla salute pubblica ma anche sui costi del Servizio sanitario nazionale. Pochi sanno che spendiamo di più per spese sanitarie dirette legate alle reazioni avverse da farmaci rispetto a quanto spendiamo per prescrivere i farmaci [3].
Fa riflettere il fatto che durante lo studio all’Unità di farmacologia medica siano pervenute solo 32 schede di segnalazione di reazione avversa relative ai pazienti entrati nel progetto GARDA. Tra i farmaci più segnalati troviamo molecole di largo consumo come acido acetilsalicilico, amoxicillina, warfarin e farmaci inclusi nei programmi di monitoraggio tramite i registri AIFA quali exenatide, sorafenib o lenalidomide. Le informazioni sulle reazioni avverse provenienti dai registri e i progetti di farmacovigilanza attiva, che tuttora proseguono in molti reparti di Pronto soccorso negli ospedali della Lombardia, influenzano ovviamente il tipo di segnalazioni raccolte che non rispecchiano così l’utilizzo dei farmaci nella popolazione. Ciò spiega anche la bassa percentuale di reazioni gravi per alcuni di questi farmaci. Pur non essendo strettamente legate alla segnalazione spontanea queste segnalazioni forniscono però utili informazioni, come per esempio lo studio GARDA (vedi box). Vi è poi un effetto traino di questi progetti che potrà essere valutato solo una volta conclusi.
Di seguito vengono riferiti e commentati alcuni segnali emersi nel corso del 2009. La lista completa dei segnali con il loro commento è disponibile sul sito web del GIF.
Complessivamente al 31 dicembre 2009 la banca dati GIF conteneva 61 segnalazioni di reazioni muscolo-scheletriche da inibitori di pompa: 12 da lansoprazolo, 13 da omeprazolo, 7 da rabeprazolo, 6 da pantoprazolo e 23 da esomeprazolo. Le reazioni riguardano: 31 mialgie, 16 artralgie, 6 casi di debolezza muscolare, 3 rabdomiolisi, 3 tendiniti, 2 artriti e 1 miopatia.
Un’analisi nel database del GIF ha confermato che tali farmaci sono tra le classi più coinvolte nella comparsa di questi eventi. Nonostante i disturbi muscolari siano noti per gli inibitori di pompa, la correlazione causale è ancora oggetto di indagine poiché allo sviluppo di queste reazioni possono contribuire molti altri fattori quali l’età, il dosaggio elevato, le malattie renali e le interazioni farmacologiche [7] .Sebbene nei casi discussi siano presenti fattori confondenti (per esempio farmaci concomitanti) è opportuno considerare la comparsa di possibili reazioni muscolari durante il trattamento con inibitori di pompa.
La segnalazione spontanea ha avuto un’ulteriore forte crescita numerica nel corso del 2009 e i primi mesi del 2010 mostrano che la tendenza all’aumento continua. Nel sito del Gruppo interregionale di farmacovigilanza è pubblicata un’analisi dettagliata della situazione relativa al 2009 (www.gruppogif.org). In questo articolo ci limitiamo a richiamare i punti più importanti di questa analisi.
Nel 2009 le segnalazioni sono state 14.583 con un tasso di segnalazione di 242,9 segnalazioni per milione di abitanti e un incremento del 27% rispetto al 2008. L’incremento ha riguardato sia i farmaci (+16%) sia i vaccini (+77%); complessivamente le segnalazioni da vaccino rappresentano il 24% del totale delle segnalazioni, incluse ovviamente quelle relative al vaccino pandemico (che abbiamo commentato nello scorso numero di FOCUS). Pur tenendo conto degli effetti della pandemia H1N1 è indubbio che la segnalazione spontanea in Italia continui a crescere. Le ragioni di questo buon andamento sono molte e sono state già discusse negli anni scorsi: buon coordinamento e finanziamento delle attività di farmacovigilanza da parte dell’Agenzia italiana del farmaco, inserimento e operatività dei Centri regionali di farmacovigilanza, impegno nelle attività di formazione/incentivazione dei segnalatori e nella raccolta dei dati da parte dei responsabili di farmacovigilanza delle ASL.
La figura sopra mostra il tasso di segnalazione del 2009 nelle diverse regioni.
Con le sole eccezioni di Toscana (-3%), Puglia (-17%) e Abruzzo (-24%) le segnalazioni sono aumentate in tutte le regioni. L’aumento più vistoso è stato registrato in Molise (tasso di segnalazione da 41 a 387, 124 segnalazioni totali nel 2009). La Lombardia è la regione con il maggiore tasso di segnalazione (ben 581 segnalazioni per milione di abitanti con un incremento del 43% rispetto al 2008) e il maggior numero assoluto di segnalazioni (5.661, circa il 40% del totale). La variabilità è comunque alta e molte regioni densamente popolate quali la Sicilia, il Piemonte, la Campania, la Puglia e il Lazio hanno tuttora un tasso di segnalazione basso. Ciò rende possibile in prospettiva un’ulteriore crescita del sistema. Circa il 30% delle segnalazioni sono definite gravi, in gran parte perché è riferita l’ospedalizzazione o il prolungamento dell’ospedalizzazione, includendo 181 casi a esito fatale. I valori sono in linea con quanto segnalato negli anni precedenti e ribadiscono la rilevanza del problema delle reazioni avverse da farmaco, spesso sottovalutato dagli operatori sanitari. E’ noto infatti che solo il 5% delle reazioni avverse che avvengono nella pratica medica viene segnalato [1].
Ma i dati relativi alla gravità delle reazioni diventano ancora più rilevanti se li associamo al fatto che almeno il 50% delle reazioni avverse, secondo quanto riportato in letteratura, può essere giudicato prevenibile e quindi anche evitabile [2]. E’ evidente come investire in questo settore possa avere importanti ricadute non solo sulla salute pubblica ma anche sui costi del Servizio sanitario nazionale. Pochi sanno che spendiamo di più per spese sanitarie dirette legate alle reazioni avverse da farmaci rispetto a quanto spendiamo per prescrivere i farmaci [3].
GARDA: LE REAZIONI AVVERSE IN GERIATRIA
Si è recentemente concluso lo studio GARDA (Geriatric Adverse Reaction Drug Assumption) che ha coinvolto sia medici sia infermieri di 3 reparti di geriatria dell’Azienda ospedaliera universitaria integrata di Verona. Lo scopo era di determinare l’incidenza delle reazioni avverse come causa di ricovero e durante la degenza in pazienti con età ≥65 anni. Sono stati arruolati 1.023 pazienti, di questi 354 (34,6%) hanno avuto una reazione avversa; in 114 pazienti (11,1% del totale) la reazione avversa è stata la causa del ricovero e in 256 pazienti (25,0% del totale) si è manifestata durante la degenza. Le reazioni avverse più segnalate sono state gli squilibri elettrolitici; al primo posto l’iponatriemia come causa di ricovero e l’ipokaliemia durante la degenza. I diuretici sono stati i farmaci più spesso coinvolti.Fa riflettere il fatto che durante lo studio all’Unità di farmacologia medica siano pervenute solo 32 schede di segnalazione di reazione avversa relative ai pazienti entrati nel progetto GARDA. Tra i farmaci più segnalati troviamo molecole di largo consumo come acido acetilsalicilico, amoxicillina, warfarin e farmaci inclusi nei programmi di monitoraggio tramite i registri AIFA quali exenatide, sorafenib o lenalidomide. Le informazioni sulle reazioni avverse provenienti dai registri e i progetti di farmacovigilanza attiva, che tuttora proseguono in molti reparti di Pronto soccorso negli ospedali della Lombardia, influenzano ovviamente il tipo di segnalazioni raccolte che non rispecchiano così l’utilizzo dei farmaci nella popolazione. Ciò spiega anche la bassa percentuale di reazioni gravi per alcuni di questi farmaci. Pur non essendo strettamente legate alla segnalazione spontanea queste segnalazioni forniscono però utili informazioni, come per esempio lo studio GARDA (vedi box). Vi è poi un effetto traino di questi progetti che potrà essere valutato solo una volta conclusi.
Di seguito vengono riferiti e commentati alcuni segnali emersi nel corso del 2009. La lista completa dei segnali con il loro commento è disponibile sul sito web del GIF.
Metoclopramide e disturbi della visione
Al 31 dicembre 2009 nel database GIF erano presenti 12 segnalazioni (4 con età <16 anni) relative a disturbi della visione durante il trattamento con metoclopramide da sola (11 casi) o in associazione (1 caso). La reazione più frequente è la diplopia (4 casi). Tutte le reazioni sono comparse con breve latenza (da 20 minuti a 2 giorni) dall’inizio del trattamento, sono rapidamente scomparse o migliorate alla sospensione e si accompagnano a disturbi di natura extrapiramidale (tranne i casi di offuscamento della visione, dove sono presenti farmaci per i quali tale reazione è nota). Queste reazioni extrapiramidali sono più frequenti nei bambini (aumento del rischio pari a 73),[4] soprattutto con dosaggi superiori a 0,5 mg/kg/die, compaiono di norma nei primi giorni di trattamento e si risolvono entro 24 ore dall’interruzione del farmaco. [2-5] A causa della possibile comparsa di questi effetti nel 2004 il Ministero della salute ha deciso di controindicarne l’uso nei bambini di età inferiore ai 16 anni.1 Alcune schede tecniche riportano la comparsa di reazioni extrapiramidali di vario tipo, tra cui spasmi dei muscoli extraoculari con crisi oculogire [6].Lansoprazolo e rabdomiolisi
Nel 2009 sono pervenute 2 segnalazioni di rabdomiolisi in corso di terapia con lansoprazolo. Il primo caso riguarda una donna di 66 anni che ha sviluppato la reazione (CPK 29.273 UI/l) dopo circa 3 anni di trattamento con il farmaco alla dose di 30 mg/die. La paziente era affetta anche da artrite reumatoide e assumeva idrossiclorochina (200 mg/die), sempre da 3 anni. A seguito della sospensione di entrambi i farmaci la reazione si è risolta entro 10 giorni. Un secondo caso di rabdomiolisi con insufficienza renale acuta (creatinina 8,86 mg/dl, CPK-MB 5.510 UI/l) si è sviluppato in un soggetto di 79 anni in terapia da più di 2 anni con lansoprazolo (30 mg/die) insieme a simvastatina (40 mg/die) e olmesartan-idroclorotiazide (20 mg/die). Dopo circa 10 giorni dalla sospensione di tutti e tre i farmaci si è avuta una completa risoluzione della reazione. Nella banca dati GIF è presente un altro caso di rabdomiolisi con insufficienza renale acuta, correlato all’uso di omeprazolo, in un soggetto diabetico di 52 anni, in trattamento anche con glibenclamide-metformina da 17 mesi; ulteriori informazioni non sono riportate nella scheda, tranne quella relativa alla guarigione del paziente.Complessivamente al 31 dicembre 2009 la banca dati GIF conteneva 61 segnalazioni di reazioni muscolo-scheletriche da inibitori di pompa: 12 da lansoprazolo, 13 da omeprazolo, 7 da rabeprazolo, 6 da pantoprazolo e 23 da esomeprazolo. Le reazioni riguardano: 31 mialgie, 16 artralgie, 6 casi di debolezza muscolare, 3 rabdomiolisi, 3 tendiniti, 2 artriti e 1 miopatia.
Un’analisi nel database del GIF ha confermato che tali farmaci sono tra le classi più coinvolte nella comparsa di questi eventi. Nonostante i disturbi muscolari siano noti per gli inibitori di pompa, la correlazione causale è ancora oggetto di indagine poiché allo sviluppo di queste reazioni possono contribuire molti altri fattori quali l’età, il dosaggio elevato, le malattie renali e le interazioni farmacologiche [7] .Sebbene nei casi discussi siano presenti fattori confondenti (per esempio farmaci concomitanti) è opportuno considerare la comparsa di possibili reazioni muscolari durante il trattamento con inibitori di pompa.
Natalizumab e alterazioni del ciclo mestruale
Al 31 dicembre 2009 nel database GIF erano presenti 3 segnalazioni di alterazioni del ciclo mestruale (1 menometrorragia, 1 oligomenorrea e 1 polimenorrea) verificatesi in tre donne (età media 40 anni) con sclerosi multipla in trattamento con natalizumab. Da questi casi emerge un’ampia variabilità nel tempo d’insorgenza della reazione dall’inizio della terapia (da 20 giorni a otto mesi). Per quanto riguarda l’esito, disponibile in 2 casi, vi è stato un miglioramento e una completa guarigione. Il database dell’OMS conteneva al 10 maggio scorso 37 segnalazioni di alterazioni del ciclo mestruale da natalizumab. I disturbi del ciclo mestruale non sono citati nella scheda tecnica europea, ma sono riportati in quella statunitense. Questa riporta, infatti, amenorrea (2%), ciclo mestruale irregolare (5%), cisti ovariche (2%) e dismenorrea (2-6%). Tali disordini sono citati anche in altre fonti.[8,9] Le differenze nelle schede tecniche appaiono ingiustificate e sarebbe auspicabile un’uniformità d’informazione.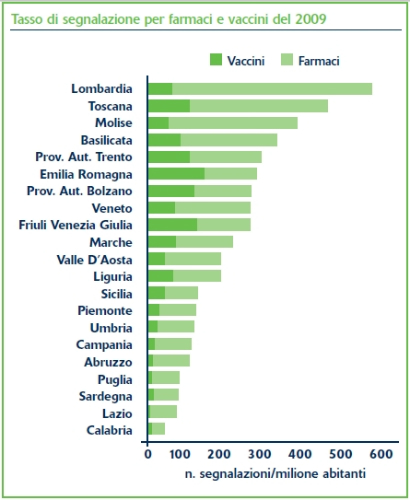
Bibliografia:
- Drug Saf 2006;29:385-96.
- Arch Intern Med 2008;168:1890-6.
- J Am Pharm Assoc 2001;41:192-9.
- Nota informativa importante del Ministero della salute, marzo 2004.
- Arch Dis Child 1980;55:310-12.
- Optom Vis Sci 1989;66:179-80.
- Pediatrics 2006;118:746-52. CDI #nrr#
- South Med J 2006;99:1290-1.
- REFI
- Curr Drug Saf 2007;2:47-63.
- Merck Manual (ultima revisione: dicembre 2009)
- J Am Pharm Assoc 2005;45:185-218.