Reazioni avverse ai farmaci oncologici: segnalazione spontanea e signal detection
E’ davvero difficile raccogliere e analizzare le segnalazioni sui nuovi farmaci oncologici ma è indispensabile farlo per la sicurezza dei pazienti
er quanto la segnalazione spontanea sia considerata lo strumento più efficace per l’identificazione di reazioni avverse ai farmaci sconosciute e clinicamente rilevanti, in alcuni settori della medicina questo metodo può avere delle limitazioni legate alla peculiarità dei pazienti trattati e dei farmaci utilizzati. Uno di questi settori è l’oncologia.
In considerazione della rilevanza clinica della patologia, la ricerca di nuovi farmaci in campo oncologico è estremamente attiva e nuove molecole vengono autorizzate in alcune circostanze con procedure accelerate rispetto a farmaci destinati alla cura di altre patologie. Una fase pre registrativa più rapida implica, almeno in linea teorica, che le conoscenze sulla sicurezza di questi farmaci al momento dell’approvazione per l’uso siano più limitate. Uno studio condotto da Seruga et al. nel 2011 ha confrontato i riassunti delle caratteristiche del prodotto (RCP) aggiornati di 12 farmaci oncologici mirati (target therapy, per esempio gli anticorpi monoclonali) con i riassunti delle caratteristiche del prodotto degli stessi farmaci al momento della prima autorizzazione al commercio, identificando 76 reazioni gravi (di cui 38 potenzialmente fatali). Di queste, 49 (58%) non erano riportate nell’RCP al momento della prima autorizzazione.1
Il problema della sottosegnalazione Questo e altri studi testimoniano la necessità di un monitoraggio “intensivo” della sicurezza di queste terapie, che tuttavia incontra alcune resistenze. Se la sottosegnalazione è un problema comune in farmacovigilanza, è verosimile che per i farmaci oncologici il fenomeno sia particolarmente marcato per molti motivi. Un primo motivo risiede nella complessità delle terapie stesse che complica enormemente la segnalazione. Infatti i dettagli necessari per una buona segnalazione (per esempio le linee di trattamento precedenti, la somministrazione di boli e dosi cicliche che possono variare nel tempo in base alla risposta terapeutica eccetera) possono essere registrati con difficoltà nelle schede di segnalazione standard.2 Altri motivi possono essere ricercati nell’attitudine dell’oncologo a segnalare la reazione avversa. La percezione del rapporto beneficio/ rischio di un trattamento da parte del medico è normalmente condizionata dalla gravità della prognosi della malattia da trattare. Pertanto le reazioni avverse ai farmaci oncologici possono essere considerate come problemi secondari, collocando la segnalazione spontanea tra le attività a priorità ridotta nella routine della pratica clinica. La tendenza quindi è di segnalare solo reazioni molto gravi o insolite poiché, in considerazione del numero elevato di reazioni osservate, è necessario attuare una qualche “discrezione pratica”. Inoltre l’identificazione di un rapporto di causa-effetto è piuttosto complicata ed è più facile attribuire un evento avverso alla progressione del tumore o ad altre patologie concomitanti che spesso si osservano nei pazienti oncologici.
E’ importante anche notare che le nuove terapie oncologiche assicurano una maggiore efficacia rispetto al passato sia in termini di numero di pazienti che rispondono alla terapia, sia in termini di sopravvivenza libera da malattia. Questo implica che per i nuovi farmaci il livello di “accettabilità” di tossicità sia più alto, con ulteriore diminuzione della segnalazione. Infine le conoscenze sulla sicurezza dei nuovi farmaci sono estremamente dinamiche: di solito i nuovi farmaci oncologici vengono valutati su pazienti terminali nelle fasi pre registrative e l’approvazione è sempre condizionata dall’impiego come seconde o terze linee di trattamento. Ma se il farmaco è efficace progressivamente diventa una prima linea di trattamento e viene usato in pazienti molto meno fragili. Questo implica una maggiore sopravvivenza e la necessità di indagare effetti avversi “a medio e a lungo termine” che non possono essere identificati nei pazienti terminali delle fasi pre registrative. Per esempio gli effetti cardiovascolari a lungo termine delle terapie oncologiche sono diventati una priorità che non era mai stata considerata in precedenza, tanto da favorire lo sviluppo di una disciplina dedicata come la “cardio-oncologia”.3
La difficile analisi del segnale
Questi problemi legati alla segnalazione hanno implicazioni importanti, anche nella fase di analisi del segnale. L’analisi del segnale può essere normalmente effettuata seguendo due direttrici fondamentali che potremmo definire l’“approccio qualitativo” e l’“approccio quantitativo”. L’approccio qualitativo è quello storicamente più “primitivo” e consiste nella valutazione degli eventi osservati nella forma di serie di casi più o meno numerose cercando analogie e differenze tra i casi osservati che permettano di imparare a gestire clinicamente i casi quando si presentano e a cercare di evitarli attraverso l’identificazione di fattori di rischio potenziali. L’approccio quantitativo è più recente e prevede l’applicazione di metodi statistici per verificare se, all’interno di una banca dati, l’associazione tra un farmaco e un evento si manifesta con frequenza maggiore di altri eventi rispetto a uno standard, che di solito è la frequenza di quell’evento rispetto a tutti gli altri eventi per tutti gli altri farmaci della banca dati.
L’approccio quantitativo prevede misure di rischio (disproporzione) che possono essere suddivise in non-bayesiane o frequentistiche oppure bayesiane. In linea teorica l’approccio quantitativo dovrebbe essere utilizzato in prima battuta per generare delle ipotesi, la cui plausibilità clinica dovrebbe essere verificata tramite l’approccio qualitativo (tenendo conto che la conferma dei segnali viene poi da studi eziologici, spesso osservazionali, ma talvolta sono necessari trial controllati e randomizzati). Tutti questi metodi sono stati utilizzati anche per identificare segnali potenziali di rischio associati alle terapie oncologiche, e tuttavia l’interpretazione dei risultati a volte è complicata. Una revisione sistematica della letteratura ci ha permesso di identificare 27 studi finalizzati a valutare i segnali di rischio per alcune terapie oncologiche (tabella 1).4 La maggior parte di questi studi (n=24) è stata effettuata utilizzando l’Adverse Events Reporting System della Food and Drug Administration (probabilmente perché questa banca dati piuttosto ampia è a disposizione della comunità scientifica e non riservata solo alle Agenzie regolatorie, come Eudravigilance). Nove studi hanno integrato i dati di segnalazione spontanea con i casi descritti in letteratura e due studi hanno presentato casi originali. In tre studi sono stati usati dati di prescrizione come denominatore per valutare l’incidenza dei report. Gli studi sono stati disegnati con diversi scopi, più spesso per identificare una relazione tra un farmaco e un evento avverso specifico (n=7) ma anche per verificare l’associazione tra un farmaco specifico e una classe di reazioni (n=5) o tra una classe di farmaci e una specifica reazione (n=2), o tra una classe di farmaci e una classe di reazioni (n=4). In 12 studi è stato utilizzato solo l’approccio qualitativo, in 9 studi solo l’approccio quantitativo e solo in 6 un approccio integrato. Quindici studi hanno valutato reazioni avverse già riportate in scheda tecnica, e 6 hanno valutato reazioni avverse già descritte in letteratura. Solo 5 studi hanno effettivamente identificato reazioni avverse completamente inattese.
Tabella 1. Studi condotti su database di segnalazione spontanea di reazioni avverse che includono farmaci oncologici
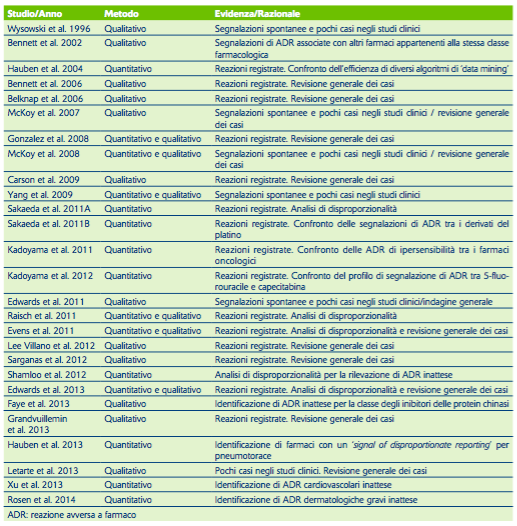 Se consideriamo l’approccio quantitativo, sia il metodo frequentistico sia quello bayesiano si sono dimostrati efficaci nell’identificare segnali di rischio, sebbene apparentemente il metodo bayesiano sembri consentire una identificazione più rapida del segnale a partire dal momento in cui il farmaco è entrato nell’uso clinico. Tuttavia, per certe reazioni avverse l’identificazione del segnale richiede comunque anni di segnalazione prima di emergere “numericamente” come tale, per esempio nel caso delle reazioni avverse cardiovascolari. Queste reazioni sono complicanze comuni di molte malattie e difficilmente si sospetta che siano correlate al farmaco. L’uso di banche dati di segnalazione spontanea sembra essere in questo senso di scarsa utilità ed è preferibile una valutazione che preveda l’uso di registri di malattia o di trattamento.
Se consideriamo l’approccio quantitativo, sia il metodo frequentistico sia quello bayesiano si sono dimostrati efficaci nell’identificare segnali di rischio, sebbene apparentemente il metodo bayesiano sembri consentire una identificazione più rapida del segnale a partire dal momento in cui il farmaco è entrato nell’uso clinico. Tuttavia, per certe reazioni avverse l’identificazione del segnale richiede comunque anni di segnalazione prima di emergere “numericamente” come tale, per esempio nel caso delle reazioni avverse cardiovascolari. Queste reazioni sono complicanze comuni di molte malattie e difficilmente si sospetta che siano correlate al farmaco. L’uso di banche dati di segnalazione spontanea sembra essere in questo senso di scarsa utilità ed è preferibile una valutazione che preveda l’uso di registri di malattia o di trattamento.Anche le reazioni neuropsichiatriche dei farmaci oncologici sembrano essere identificate con difficoltà e richiedono anni di raccolta dati. Questo probabilmente per due motivi: il primo è che il 25-30% dei pazienti oncologici ha una patologia psichiatrica (ansia, malattie stress-correlate, depressione) che molto spesso può essere attribuita a sindromi paraneoplastiche (per esempio da metastasi cerebrali) e quindi non c’è la segnalazione. Il secondo è che le reazioni psichiatriche sono comuni per molti farmaci, situazione che “diluisce” il segnale all’interno della banca dati che utilizza come controllo proprio lo standard di tutti gli altri farmaci.
Un altro potenziale ostacolo sta nel fatto che molti nuovi farmaci antitumorali sono anticorpi monoclonali. Per questa superclasse di farmaci è stato dimostrato un profilo diverso di segnalazione rispetto ai farmaci oncologici tradizionali.5 Per questi farmaci va valutato se è corretto utilizzare come standard tutti gli altri farmaci, oppure se sia più opportuno utilizzare come controllo solo i farmaci biotecnologici. L’approccio puramente qualitativo normalmente è originato da pochi casi pubblicati in letteratura o da agenzie regolatorie. La maggiore limitazione sembra proprio quella di non essere in grado di anticipare l’identificazione di segnali inattesi ma solo di confermare segnali noti. E’ interessante citare l’esempio del gruppo RADAR poi evoluto in SONAR che ha effettuato diverse valutazioni “qualitative” per farmaci oncologici utilizzando un protocollo che integra i casi registrati nelle banche dati di segnalazioni spontanee con quelli di letteratura e quelli di un network clinico costruito da questo gruppo.6 Il punto di forza di questo protocollo è che l’analisi dei dati viene iniziata solo se emergono contemporaneamente una rilevanza clinica e una plausibilità biologica dell’evento in questione. Va anche segnalata l’efficacia di progetti di farmacovigilanza attiva, come il progetto Farmaonco della Regione Lombardia che, oltre a identificare reazioni avverse non note, ha avuto il vantaggio di diffondere la cultura della sicurezza dei farmaci antitumorali tra gli specialisti oncologi.
Un approccio praticabile
Quindi l’identificazione di reazioni avverse a farmaci oncologici utilizzando approcci quantitativi sembra fattibile e utile per uno screening periodico della sicurezza di un certo protocollo di trattamento, sebbene la qualità dei dati possa influire molto sui risultati dell’analisi e sia scarsamente applicabile ad alcune tipologie di reazione avversa (cardiovascolari, psichiatriche). La valutazione qualitativa dei segnali di disproporzione sembra essere un elemento chiave sia per validare segnali identificati con altri metodi, sia per identificare nuovi segnali in situazioni nelle quali le informazioni siano disseminate su diverse fonti e non solo nei database di segnalazione spontanea. La gran parte degli studi è stata effettuata sulla banca dati AERS e sarebbe auspicabile una disponibilità open source anche per altre banche dati (per esempio Eudravigilance e Vigibase) in modo da poter confrontare i risultati ottenuti da diverse fonti. L’introduzione di strategie per migliorare la qualità dei dati sulle segnalazioni dei farmaci oncologici, come per esempio l’introduzione di schede di segnalazione specifiche, potrebbe potenziare la capacità di individuare precocemente reazioni nuove e inattese per queste terapie.
- J Clin Oncol 2011;29:174-85. CDI
- Clin Pharmacol Ther 2010;88:231-6. CDI
- Intern Emerg Med 2012;7:113-31. CDI
- Expert Rev Clin Pharmacol. 2015; 8: 61-75. CDI
- Pharmacotherapy 2004;24:743-9. CDI NS
- Commun Oncol 2008;5:31-2.
1 Azienda Ospedaliero Universitaria Pisana, Centro Regionale Toscano di Farmacovigilanza
2 Centro Interdipartimentale di Ricerche di Farmacologia Clinica e Terapia Sperimentale, Università di Pisa