L’eruzione bollosa della signora Vanessa
Vanessa è una donna di 80 anni, affetta da diabete mellito di tipo 2, per cui assume quotidianamente insulina e linagliptin. Inoltre la sua terapia domiciliare cronica comprende warfarin, acido acetilsalicilico, telmisartan, doxazosina, simvastatina e pantoprazolo.
La paziente si presenta in ospedale per l’insorgenza di un’eruzione cutanea bollosa estesa a tutto il corpo, associata a prurito intenso. Dopo un inefficace approccio con terapia steroidea locale, nel sospetto di una reazione avversa a warfarin, si opta per la sua sostituzione con enoxaparina. A causa del persistere dei sintomi, Vanessa viene ricoverata nel reparto di Medicina d’urgenza, dove inizia un trattamento con steroidi per via endovenosa e amoxicillina/acido clavulanico per via orale, congiuntamente all’applicazione di crema steroidea e garze grasse.
La paziente viene successivamente trasferita nel reparto di Cure subacute dove, tramite biopsia di due campioni perilesionali, viene posta diagnosi di pemfigoide bolloso, che rileva il caratteristico deposito di IgG a livello della giunzione tra membrana basale ed epidermide. Per tale motivo, si incrementa la terapia steroidea sistemica, a cui si associa metotrexato settimanale sottocute. Nell’arco di pochi giorni, però, il decorso clinico si complica ulteriormente con episodi febbrili ricorrenti, versamento pleurico e candidosi orale. Si imposta quindi una terapia antibiotica con piperacillina/tazobactam, nistatina topica e fluconazolo. Viene altresì riscontrata agranulocitosi, attribuita alla terapia con metotrexato, che viene sospeso. Si procede a un trattamento con folina e antibiotici a largo spettro (vancomicina e meropenem), successivamente si imposta terapia con morfina e aloperidolo per via sottocutanea e la paziente viene stabilizzata.
La spiegazione e i rischi
Il pemfigoide bolloso è una patologia autoimmune, a frequenza rara, caratterizzata dallo sviluppo di placche orticarioidi e vescicole dense subepiteliali.
I meccanismi che portano all’insorgenza del pemfigoide bolloso non sono ancora pienamente compresi, ma molto probabilmente coinvolgono un danno anticorpo-mediato diretto verso due proteine della membrana basale epiteliale. Numerose prove suggeriscono che la reazione autoimmune possa essere anche scatenata dall’esposizione a diverse classi di farmaci, tra cui gli inibitori della DPP-4 (o gliptine):1-8 in particolare il Riassunto delle caratteristiche del prodotto (RCP) di linagliptin, assunto dalla signora, riporta il pemfigoide bolloso come effetto indesiderato noto, a frequenza rara.
Al fine di indagare i potenziali segnali correlati alla comparsa di ipoglicemia in seguito all’esposizione alle gliptine e di confrontare il loro tasso di segnalazione con quello relativo agli altri ipoglicemizzanti orali, è stata condotta un’analisi case/non-case delle reazioni avverse notificate nella banca dati di farmacovigilanza gestita dall’Organizzazione Mondiale della Sanità (VigiBase®), in un ampio intervallo temporale (2006-2018).
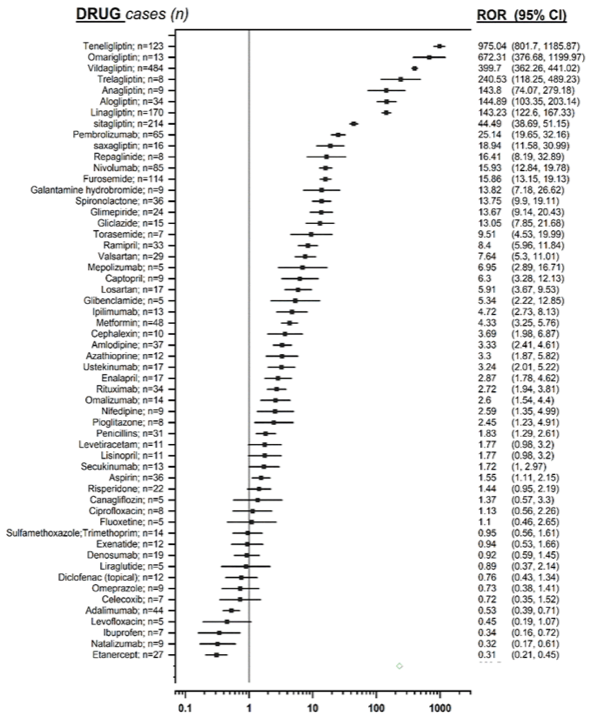
La forza dell’associazione tra inibitori della DPP-4 e ipoglicemia è stata stimata calcolando il Reporting Odds Ratio (ROR) (indice di stima della disproporzionalità, ovvero maggiore di quanto atteso) e il suo intervallo di confidenza al 95% (IC95). Da questa analisi è emerso che le gliptine sono i farmaci associati alla maggior frequenza di segnalazione di pemfigoide bolloso (ROR: 179,48, limiti di confidenza al 95% da 166,41 a 193,58); in particolar modo ogni singolo farmaco appartenente a questa classe farmacologica ha rivelato un ROR significativo.
Selezionando i casi che riportano le gliptine come gli unici farmaci sospetti, i valori di disproporzionalità diminuiscono, ma mantengono la significatività statistica.
È stata infine condotta un’analisi di sensibilità, al fine di verificare l’attendibilità delle analisi precedenti, comparando il numero di casi di pemfigoide bolloso indotto da gliptine con il numero di casi correlati ai farmaci notoriamente associati a tale evento. Essa ha confermato un segnale maggiore per le gliptine rispetto a qualsiasi altro farmaco (vedi Figura 1).
Allo scopo di esplorare il meccanismo farmacologico alla base dell’induzione iatrogena del pemfigoide bolloso, è stato studiato il ruolo potenziale delle misure di affinità per il target biologico che determina l’effetto terapeutico (DPP-4) e per target secondari (DPP-2, DPP-8 e DPP-9); sono anche stati tracciati dei profili di selettività di ciascuna gliptina. Si è scelto, inoltre, di studiare il diverso volume di distribuzione delle varie gliptine, poiché l’ipotesi postulata è che una gliptina ad alto volume di distribuzione possa accedere più efficacemente agli enzimi a localizzazione intracellulare (DPP-8 e DPP-9).
Al fine di studiare se ci fosse una correlazione tra i diversi valori dei parametri farmacologici delle singole gliptine e le relative misure di ROR stimate, sono stati impiegati modelli di regressione lineare. Da questa analisi non sono emerse associazioni significative tra le diverse variabili studiate: l’affinità per l’enzima DPP-4 è quella che si è avvicinata maggiormente alla significatività statistica (p=0,067, R2=0,40), lasciando presuppore che all’aumentare dell’affinità per il target farmacologico ci si possa aspettare in qualche misura un aumento della frequenza di segnalazione.
Sebbene significative, le misure di disproporzionalità individuate non consentono di stimare il rischio effettivo, né di provare alcuna associazione causale e per tale motivo sono necessari futuri studi preclinici e clinici volti a valutare meglio questa correlazione, incluso il potenziale meccanismo coinvolto nell’eziopatogenesi di questa grave patologia invalidante.
I risultati delle nostre analisi attribuiscono agli inibitori della DPP-4 la più alta frequenza di segnalazione di pemfigoide bolloso rispetto a ogni altra classe farmacologica. Si consiglia quindi di monitorare attentamente tutti i possibili sintomi che potrebbero essere riconducibili al pemfigoide bolloso e, in caso di sospetta insorgenza, si consiglia l’interruzione del trattamento.
Figura 1. Forest plot che raffigura su scala logaritmica le misure di disproporzionalità dei farmaci analizzati (le gliptine risultano gli agenti farmacologici associati ai valori di ROR più elevati)
Per ingrandire il grafico cliccare sull'immagine
- Garcia-Diez I, et al. Bullous pemphigoid induced by dipeptidyl peptidase-4 inhibitors. Eight cases with clinical and immunological characterization. Int J Dermatol 2018;57:810. CDI
- Gaudin O, et al. Gliptin accountability in mucous membrane pemphigoid induction in 24 out of 313 patients. Front Immunol 2018;9:1030. CDI
- Kawaguchi Y, et al. Dipeptidyl peptidase-4 inhibitors-associated bullous pemphigoid: a retrospective study of 168 pemphigoid and 9,304 diabetes mellitus patients. J Diab Investig 2019;10:392. CDI
- Arai M, et al. Bullous pemphigoid and dipeptidyl peptidase-4 inhibitors: a disproportionality analysis based on the Japanese Adverse Drug Event Report Database. Diab Care 2018;41:e130. CDI
- Lee S, et al. Association of dipeptidyl peptidase-4 inhibitor use with risk of bullous pemphigoid in patients with diabetes. JAMA Dermatol 2019;155:172. CDI
- Plaquevent M, et al. Higher frequency of dipeptidyl peptidase-4 inhibitor intake in bullous pemphigoid patients than in the French general population. J Invest Dermatol 2018;139:835-41. CDI
- Garcia M, et al. Dipeptidyl peptidase-IV inhibitors induced bullous pemphigoid: a case report and analysis of cases reported in the European pharmacovigilance database. J Clin Pharm Ther 2016;41:368-70. CDI
- Carnovale C, et al. Bullous pemphigoid induced by dipeptidyl peptidase-4 (DPP-4) inhibitors: a pharmacovigilance-pharmacodynamic/pharmacokinetic assessment through an analysis of the Vigibase®. Expert Opin Drug Saf 2019;18:1099-1108. CDI
Giulia Mosini1, Michele Gringeri1, Vera Battini1, Elena Invernizzi1, Olivia Leoni2, Carla Carnovale1, Sonia Radice1
1. Servizio di Farmacovigilanza, U.O. Farmacologia Clinica, Dipartimento di Scienze Biomediche e Cliniche, ASST - Fatebenefratelli-Sacco, Università degli Studi di Milano
2. Centro Regionale di Farmacovigilanza, Regione Lombardia, Milano