I risultati dello studio europeo SALT
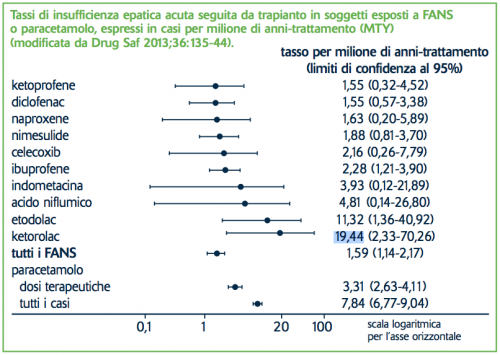
Molte reazioni avverse da farmaci sono state scoperte grazie alla segnalazione spontanea e ciò ha comportato importanti decisioni in termini di salute pubblica, fino al ritiro di alcuni farmaci dal mercato. Alcune volte, però, le decisioni da prendere non sono così chiare, come dimostra il caso della nimesulide (ndr: vedi box a lato), la cui epatotossicità ha richiamato molta attenzione. Nel corso dell’ultimo processo di arbitrato, le autorità regolatorie europee hanno chiesto che venisse realizzato uno studio sull’insufficienza epatica acuta associata a farmaci tale da portare al trapianto. E’ partito così lo studio SALT (Study of Acute Liver Transplantation). Il vantaggio di studiare l’insufficienza epatica acuta associata a farmaci rispetto ai casi di epatotossicità più lievi è che tutti i casi sono registrati in liste d’attesa, per cui è possibile identificare tutti i casi in ogni paese, senza il rischio di perderne alcuni. Questi casi venivano confrontati con i dati relativi alle vendite e all’uso dei farmaci nello stesso paese, secondo un disegno cosiddetto di caso-popolazione. Lo studio SALT ha coinvolto soggetti adulti in diversi paesi europei tra il 2005 e il 2007: Francia, Grecia, Irlanda, Italia, Paesi Bassi, Portogallo e Regno Unito. I pazienti con un’insufficienza epatica acuta sono stati individuati grazie ai registri locali o nazionali dei trapianti di fegato. Per ogni caso sono state determinate le possibili cause cliniche di insufficienza epatica e l’esposizione a FANS, a paracetamolo o ad altri farmaci nei 30 giorni precedenti alla data dei primi segni clinici o di laboratorio di insufficienza epatica. In ogni paese sono state rilevate le vendite globali dei singoli FANS e del paracetamolo in modo da poter stimare i tassi di insufficienza epatica acuta seguita da trapianto in soggetti esposti a FANS, espressi in casi per milione di anni-trattamento (MTY).1,2 Su 62 centri per il trapianto di fegato 52 hanno contribuito a fornire i dati. Di 9.479 pazienti identificati nelle liste di attesa per il trapianto di fegato in un periodo di 3 anni, 600 (6%) avevano un’insufficienza epatica acuta: 219 (36%) avevano cause cliniche, 62 (11%) non avevano né un’esposizione a farmaci né cause cliniche, mentre 301 (52%) avevano avuto un’esposizione a farmaci senza cause cliniche. Tra questi ultimi, 40 erano stati esposti a FANS. I tassi per MTY (vedi figura) erano 1,59 per tutti i FANS nel loro insieme, 2,28 per l’ibuprofene, 1,88 per la nimesulide e 1,55 per il diclofenac. Il tasso per i casi associati al paracetamolo a dosaggio normale era 3,31 rispetto a 7,84 quando venivano considerati i casi di overdose intenzionale o non intenzionale. I tassi per tutti i FANS nel loro insieme erano quasi 4 volte superiori (limiti di confidenza al 95% da 1,2 a 12,5) in Irlanda rispetto agli altri paesi messi insieme.3 Il rischio di insufficienza epatica acuta tale da portare al trapianto era molto piccolo e non sono emerse differenze tra i FANS più usati, come nimesulide, diclofenac e ibuprofene. Ma a che cosa si può ascrivere allora la differenza tra segnalazioni spontanee e studi epidemiologici? Potrebbero esserci differenze nella sensibilità dei pazienti dei vari paesi ai farmaci sulla base di predisposizioni genetiche o fattori ambientali (per esempio l’uso di birra?) o potrebbero invece entrare in gioco diversi fattori umani, come per esempio un bias di notorietà per il quale la comparsa della notizia sui media comporta un aumento delle segnalazioni, o ancora in paesi con pochi specialisti l’intima convinzione di un’unica persona che il farmaco sia dannoso, con l’aumento in tal modo della segnalazione mirata di casi esposti al farmaco piuttosto che ad altri farmaci. Nella farmacovigilanza, come in altri settori, è bene avere un sano scetticismo: senza dimenticare il principio di precauzione occorre considerare la possibilità di bias e bisogna disegnare studi adeguati. Nel caso della nimesulide il rischio di epatotossicità non sembra essere peggiore rispetto a quello di altri farmaci. Ma in medicina non vi sono certezze definitive e senza dubbio il tema va tenuto sotto osservazione. In particolare un aumento del tasso di 2-3 volte di insufficienza epatica acuta rispetto a quello associato a dosi normali di paracetamolo richiederebbe senza dubbio ulteriori approfondimenti.4 Le pubblicazioni sullo studio SALT sono riportate in bibliografia alle voci 1, 2, 3, 5.
- Eur J Clin Pharmacol 2013;69:605-16. CDI #nnn#
- Pharmacoepidemiol Drug Saf 2012;21:851-6. CDI #nnn#
- Drug Saf 2013;36:135-44. CDI #fnn#
- Brit Med J 2013;346:f1519. CDI #nnn#
- Pharmacoepidemiol Drug Saf 2013;22:160-7. CDI #nnn#
Sinem Ezgi Gulmez
professore associato di farmacologia clinica, Università di Bordeaux
Nicholas Moore
professore di farmacologia clinica, Università di Bordeaux
NIMESULIDE ED EPATOTOSSICITA'
La nimesulide ha avuto numerose valutazioni a livello europeo a causa della sua epatotossicità.
1998-1999 Prime segnalazioni di casi di epatotossicità da Israele, dove il farmaco era stato dapprima sospeso e quindi reimmesso sul mercato. Nello stesso periodo ci sono stati un caso in Portogallo e alcuni casi in un unico centro in Belgio.
2002 Segnalazione di una concentrazione di casi (66) in Finlandia, che decide la sospensione alla commercializzazione e richiede una rivalutazione del profilo di sicurezza della nimesulide al CHMP dell’EMA. Nello stesso anno la Spagna ritira la nimesulide sul territorio nazionale.
2002-2003 Il CHMP conclude che il profilo beneficio/rischio della nimesulide rimane positivo purché vengano modificate le raccomandazioni d’uso.
2004 La conclusione del CHMP viene sostenuta dalla Commissione Europea che pubblica la decisione legalmente vincolante ad aprile 2004. Le informazioni del prodotto vengono modificate per controindicare il suo uso in pazienti con insufficienza epatica e per includere avvertenze sul rischio di epatiti, epatiti fulminanti (inclusi casi fatali), ittero e colestasi e per limitare la dose orale giornaliera a un massimo di 200 mg/die.
2007 L’Agenzia del farmaco irlandese decide di sospendere la commercializzazione della nimesulide in seguito alla segnalazione da parte della National Liver Transplant Unit dell’Ospedale St. Vincent di 6 casi di insufficienza epatica grave tali da condurre al trapianto e di una revisione complessiva delle segnalazioni pervenute all’Agenzia irlandese.
Il CHMP e la Commissione Europea concludono che i benefici della nimesulide superano i rischi, ma che occorre restringere ulteriormente le indicazioni: il farmaco deve essere usato solo in seconda linea e deve essere aperta una nuova procedura che prenda in esame tutti i potenziali rischi e non solo quelli epatotossici. Durante la valutazione, il CHMP richiede che venga condotto uno studio sui centri trapianti europei (vedi articolo a fianco). Intanto l’Italia decide di modificare il regime di fornitura da ricetta ripetibile (RR) a ricetta non ripetibile (RNR) e quindi utilizzabile una sola volta.
2012 Il Comitato conclude che il profilo beneficio/rischio di nimesulide non è più favorevole nell’uso cronico del “trattamento sintomatico dell’osteoartrite dolorosa” e che pertanto l’uso deve essere limitato esclusivamente al trattamento del dolore acuto e della dismenorrea primaria sempre solo come farmaco di seconda linea, per il minor tempo possibile.