I farmaci off-label in pediatria: dalla ricerca ai bambini e ritorno
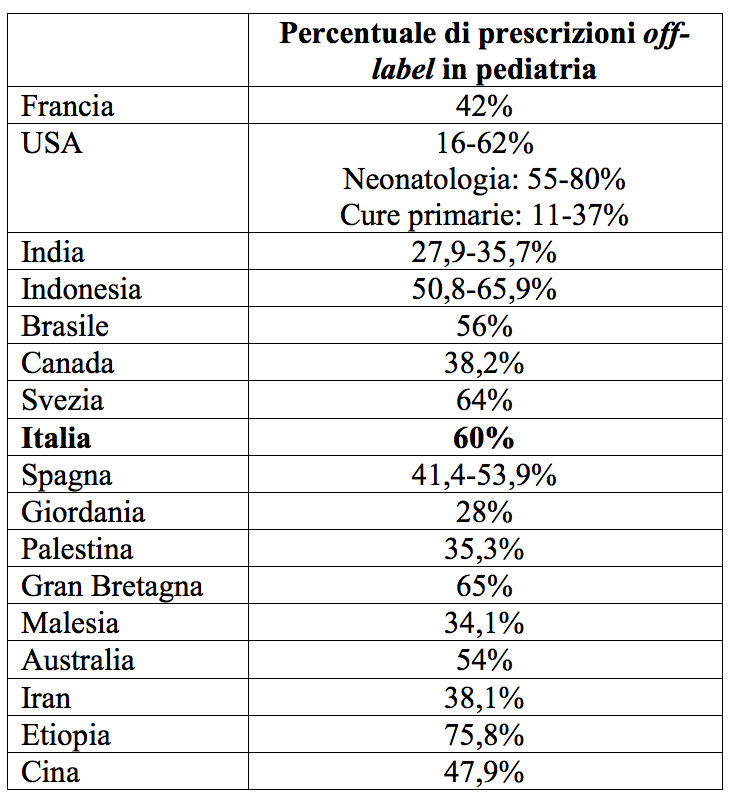
Come spesso accade – anche se non sempre risulta apparente – un unico “filo rosso” lega in maniera indissolubile ricercatori, pediatri e bambini. Nel nostro caso, si tratta dei cosiddetti farmaci off-label che rappresentano circa il 50% delle potenziali prescrizioni in età pediatrica. Parliamo di un’ampia gamma di principi attivi per i quali non esiste ancora l’autorizzazione all’uso nei bambini e che, nonostante questo, vengono comunemente impiegati, in tutto il mondo, con indicazioni, dosaggi e formulazioni non specificamente approvati per l’età pediatrica (Tabella 1).1-4
Il fenomeno riguarda i bambini piccoli più degli adolescenti e l’ambito ospedaliero più di quello delle cure territoriali.
Tabella 1. Frequenza delle prescrizioni off-label pediatriche in diverse nazioni (modificata da rif. 3)
I motivi della mancanza di studi
Per i ricercatori (e, conseguentemente, per i produttori dei principi attivi) il problema risiede nella difficoltà di condurre studi adeguatamente disegnati, dimensionati e focalizzati sul corretto target di età. Senza di questi, non è possibile ottenere dalle agenzie regolatorie le necessarie autorizzazioni perché il farmaco possa essere commercializzato anche per l’età pediatrica e possa essere riportata nella scheda tecnica la relativa indicazione. Gli ostacoli che spesso rendono difficile – e talora impraticabile – questo passaggio non sono pochi, tutti ampiamente noti e già ripetutamente affrontati in letteratura.5,6 L’aspetto etico è quello più immediatamente cogente: i bambini sono una popolazione in sé vulnerabile e questo costituisce un evidente freno alla conduzione di sperimentazioni cliniche su temi potenzialmente anche molto rilevanti. D’altra parte, nella valutazione delle proposte, i comitati etici dovrebbero avvalersi di competenze particolarmente esperte in questo ambito, in grado di vagliare correttamente la rilevanza del quesito clinico e i potenziali vantaggi che deriverebbero dalla disponibilità di un nuovo principio terapeutico adeguatamente studiato per l’uso pediatrico. Su questo aspetto, l’auspicio sarebbe che le stesse agenzie regolatorie incoraggiassero ricercatori e sponsor farmaceutici a includere nei loro studi sottopopolazioni pediatriche qualora rilevassero che il meccanismo d’azione di un farmaco potesse essere di beneficio anche per questa classe di età. Naturalmente, la successiva approvazione dell’indicazione pediatrica dovrà soddisfare i criteri di efficacia e sicurezza stabiliti da ciascuna agenzia di controllo.
È interessante, a questo proposito, quanto esplicitato nel documento dell’American Academy of Pediatrics: “L’assenza di etichettatura per uno specifico gruppo di età o per una specifica patologia non significa necessariamente che l’uso del farmaco sia improprio per quell’età o per quella patologia. Piuttosto, significa soltanto che le evidenze richieste dalla normativa per permettere l’inclusione nella scheda tecnica (etichetta) non sono state ritenute sufficienti dalla FDA. Inoltre, la mancanza di etichettatura non significa in alcun modo che quella terapia non sia supportata dall’esperienza clinica o da dati in età pediatrica. Al contrario, significa specificamente che le evidenze di efficacia e sicurezza del farmaco nella popolazione pediatrica non sono state presentate alla FDA o non hanno soddisfatto gli standard normativi di ‘prove sostanziali’ necessari per l’approvazione della FDA”.6 Diverso – conclude il documento – è il caso nel quale, nella scheda tecnica sia dichiarato che “non sono state stabilite la sicurezza e l’efficacia in età pediatrica” o che siano eventualmente riportate specifiche avvertenze o controindicazioni relative all’uso di quel farmaco nell’infanzia.
È altresì evidente che, considerando la rapida evoluzione della ricerca farmacologica, non stupisce che le schede tecniche non includano tutti gli impieghi potenzialmente vantaggiosi di un principio attivo. A questo proposito, grande rilevanza nella continua ridefinizione della sicurezza di un farmaco (per quanto in uso off-label) ha la sorveglianza post marketing e la segnalazione degli eventuali eventi avversi osservati.6
L’opinione dei pediatri
Il punto di vista dei pediatri è un po’ diverso e, allo stesso tempo, complementare. A fronte di un problema clinico rilevante (frequente in neonatologia e in terapia intensiva, per molte malattie croniche o patologie rare) per il quale l’impiego off-label di un farmaco potrebbe essere vantaggioso, il pediatra deve fare affidamento sulle migliori prove reperibili in letteratura, sul parere di esperti o su quanto codificato per l’adulto.7 È un passo, questo, che pur se compiuto nel migliore interesse del paziente, richiede l’attenta valutazione del rapporto rischi-benefici, l’ottenimento di un consenso realmente informato da parte dei genitori (e del minore stesso, se in grado di darlo) e, spesso, la necessità di produrre documentazione scientifica adeguata a supporto della propria decisione. La sensazione può essere, per il pediatra di esporsi a un incremento di responsabilità e per il paziente di essere oggetto di una sperimentazione o di una terapia di incerta efficacia. Per entrambi, può anche non esserci la precisa consapevolezza di trovarsi all’interno di un uso non codificato del farmaco, senza contare che la letteratura segnala una maggiore incidenza di eventi avversi nell’uso off-label di farmaci in pediatria.2,8-11
In realtà, nella prescrizione off-label la normativa viene in soccorso del pediatra e del suo paziente prevedendo alcune situazioni (prevalentemente di contesto ospedaliero) che consentono l’accesso gratuito a una terapia farmacologica la cui commercializzazione non sia stata ancora autorizzata da AIFA o che lo sia stata ma per una indicazione diversa da quella per la quale la si voglia utilizzare.12
] I percorsi previsti sono sostanzialmente cinque: i primi due – Legge 648/1996 e Legge 326/2003 (Fondo nazionale AIFA) – che prevedono il rimborso del farmaco, rispettivamente da parte del SSN e di AIFA per principi attivi e per patologie inclusi in elenchi aggiornati periodicamente; il terzo considera l’uso compassionevole con fornitura diretta e gratuita da parte del produttore del medicinale; il quarto consente l’uso non ripetitivo di terapie avanzate con preparazione fornita direttamente dal produttore ma con costo a carico del centro clinico; il quinto permette di accedere al trattamento con un medicinale regolarmente in commercio ma per una indicazione diversa da quella per cui è stato autorizzato (Legge 94/98 art.3, comma 2), anche in presenza di alternative terapeutiche già autorizzate. In questo caso la terapia è però a carico del paziente o del centro clinico in regime di degenza. Tutti questi percorsi si realizzano, comunque, sotto la responsabilità del medico prescrittore. (Per maggiori informazioni vedi https://www.aifa.gov.it/accesso-al-farmaco).
Off-label nella pratica
Dal punto di vista pratico, vale la pena sottolineare due aspetti cardine dell’uso off-label in pediatria: il primo riguarda il percorso prescrittivo e il secondo il tema della sicurezza per il paziente e quindi della responsabilità del pediatra. Si tratti della prescrizione ambulatoriale dell’ondansetron in corso di gastroenterite con vomito incoercibile13 o della somministrazione di un farmaco biologico in ospedale, al pediatra deve essere sempre chiara la necessità di rifarsi alle migliori evidenze di letteratura disponibili in termini di efficacia, sicurezza e rapporto rischi-benefici.
Il percorso prescrittivo è, generalmente, ben presidiato in ambito ospedaliero dove qualsiasi impiego off-label deve essere giustificato, supportato da adeguate prove di efficacia e valutato da un organismo interno di verifica. Minore controllo – e, di conseguenza, maggiore responsabilità per il pediatra prescrittore – è forse presente sul territorio e nell’interazione diretta tra il pediatra e il bambino con la sua famiglia. In entrambi i casi è evidente la necessità per il pediatra di essere sempre aggiornato non solo sulle autorizzazioni all’uso di un farmaco, ma anche sulle prove scientifiche che si evolvono nel tempo e che non hanno ancora avuto il tempo di essere ufficialmente acquisite (best practice).
Le implicazioni per la sicurezza del paziente e, di conseguenza, per il profilo di responsabilità del prescrittore appaiono del tutto evidenti e richiamano ancora una volta il pediatra all’inderogabile obbligo di agire con consapevolezza e prudenza, valutando il rapporto rischi-benefici al meglio delle conoscenze al momento disponibili.
In conclusione
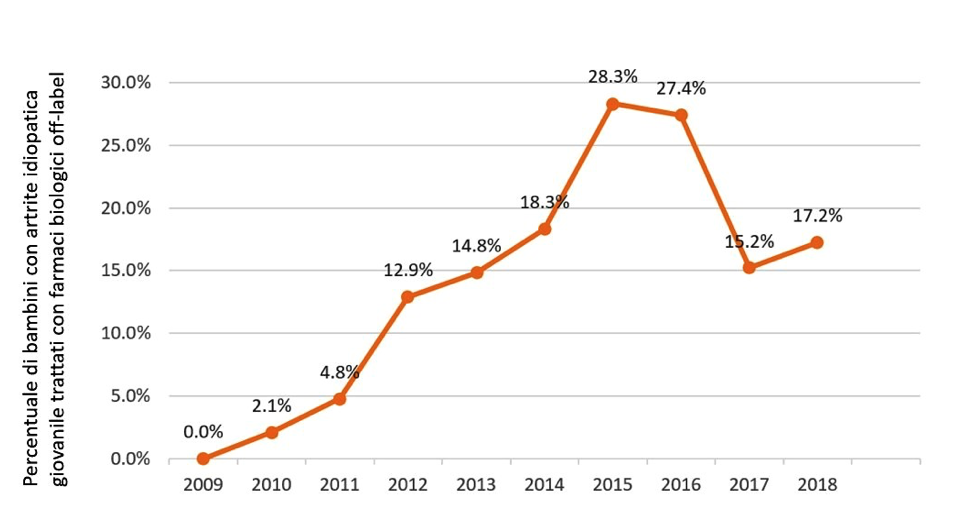
Concludiamo questo articolo parlando dei bambini, dalle cui inderogabili esigenze di cura dovrebbe trarre origine qualsiasi prescrizione off-label. Come abbiamo detto, la disponibilità di dati scientificamente solidi per la registrazione di farmaci ad uso pediatrico richiede necessariamente la conduzione di studi adeguatamente disegnati e dimensionati per numerosità ed età. L’obiettivo può non essere facilmente raggiungibile per motivi etici, di consenso da parte dei genitori/tutori o anche solo per la rarità della patologia che impedisce di raccogliere una sufficiente casistica. Esistono oltre 7.000 malattie rare: 80% sono geneticamente determinate e interessano l’età pediatrica nella metà dei casi. Solo il 5-7% di queste patologie ha una terapia farmacologica approvata dalla FDA.14 L’impiego di farmaci innovativi, quali i biologici, avviene in pediatria al di fuori delle indicazioni autorizzate nel 15% circa dei casi, con insufficienti prove di efficacia e incremento del rischio di tossicità ed eventi avversi (Figura 1). Le enormi potenzialità emergenti della farmacogenomica rappresentano una nuova sfida per la ricerca farmacologica in pediatria e ne accrescono, allo stesso tempo, la necessità e la complessità.15
Figura 1. Impiego di biologici off-label nell’artrite idiopatica giovanile negli Stati Uniti (anni 2009-2018). (modificata da rif. 14)
Volendo sottolineare il significato della ricerca a vantaggio dei bambini, vale la pena richiamare quanto affermato dall’AIFA in una campagna di comunicazione di ormai 10 anni fa, ma che mantiene inalterato il suo valore: “È necessario far comprendere che la partecipazione volontaria dei bambini e degli adolescenti agli studi clinici contribuisce a colmare la mancanza di dati, garantendo ai più piccoli maggiore qualità, sicurezza ed efficacia dei farmaci a loro destinati”.1
- AIFA. Campagna di comunicazione AIFA “Farmaci e Pediatria”. 31 Ottobre 2021, Prot. N. AA/7932/p.
- Balan S, Hassali M, Mak V. Awareness, knowledge and views of off-label prescribing in children: a systematic review. Br J Clin Pharmacol. 2015;80:1269-80. CDI
- Shanshal A, Hussain S. Off-label prescribing practice in pediatric settings: pros and cons. Sys Rev Pharm 2021;12:1267-75. CDI
- Sachs A, Avant D, Lee C, et al. Pediatric information in drug product labeling. JAMA 2012;307:1914-5.
- Nuffield Council on Bioethics. Children and clinical research: ethical issues. 14/05/2015. www.nuffieldbioethics.org/children
- Frattarelli D, Galinkin J, Green T, et al. American Academy of Pediatrics Committee on Drugs. Off-label use of drugs in children. Pediatrics 2014;133:563-7. CDI
- Balan S, Hassali M, Mak V. Two decades of off-label prescribing in children: a literature review. World J Pediatr 2018;14:528-540. CDI
- Aagaard L, Hansen E. Prescribing of medicines in the Danish paediatric population outwith the licensed age group: characteristics of adverse drug reactions. Br J Clin Pharmacol 2011;71:751-7. CDI
- Wallerstedt S, Brunlof G, Sundstrom A. Rates of spontaneous reports of adverse drug reactions for drugs reported in children: a cross-sectional study with data from the Swedish adverse drug reaction database and the Swedish Prescribed Drug Register. Drug Saf 2011;34:669-82. CDI
- Ufer M, Kimland E, Bergman U. Adverse drug reactions and off‐label prescribing for pediatric outpatients: a one-year survey of spontaneous reports in Sweden. Pharmacoepidemiol Drug Safety 2004;13:147-52. NS
- Cliff-Eribo K, Sammons H, Choonara I. Systematic review of pediatric studies of adverse drug reactions from pharmacovigilance databases. Expert Opin Drug Saf 2016;15:1321-8. CDI
- AIFA. Accesso precoce al farmaco e uso off-label. www.aifa.gov.it/accesso-precoce-uso-off-label
- Marchetti F, Bonati M, Maestro A, et al. SONDO (Study ONdansetron vs DOmperidone) Investigators. Oral ondansetron versus domperidone for acute gastroenteritis in pediatric emergency departments: multicenter double blind randomized controlled trial. PLoS One 2016;11:e0165441. CDI
- Fung A, Yue X, Wigle P, et al. Off-label medication use in rare pediatric diseases in the United States. Intractable Rare Dis Res 2021;10:238-45. CDI
- Barker C, Groeneweg G, Maitland-van der Zee A, et al. Pharmacogenomic testing in paediatrics: clinical implementation strategies. Br J Clin Pharmacol
Enrico Valletta1, Michele Gangemi2
1 UO Pediatria, Ospedale G.B. Morgagni - L. Pierantoni, AUSL Romagna, Forlì
2 Pediatra, Verona